医師個人における研究活動の意義を問われることもありますが、研究活動によって論理的思考が養われ、直接的に臨床の現場にその経験を生かすことができます。研究の本質を捉える力もつき、論文・学会報告を鵜呑みにせずに最新の医療情報に精通する基盤が形成されます。研究活動を行うことで目の前の患者さんだけでなく、世界中の患者さんの幸福に繋がる成果をあげることも不可能ではありません。それはきっと素晴らしい経験になるはずです。
当科は研究活動を基礎にした学会活動や論文業績が豊富で、ノウハウが充分に蓄積されています。世界に向けて情報発信ができるよう懇切丁寧な指導を受けることが出来るため、これまでに沢山の若手医局員が多くの業績をあげています。是非我々とともにリウマチ学の発展に力を尽くしてください。他では得がたい生きがい、働きがいを得ることが出来ると思います。
主な研究テーマ
- preclinical RAの研究(関節炎発症前の関節リウマチの病態研究)
- 全身性エリテマトーデス(SLE)に関する研究
- 全身性硬化症(全身性強皮症)に関する研究
- 多発筋炎・皮膚筋炎に関する研究
- 血管炎症候群に関する研究
- 小児リウマチの研究
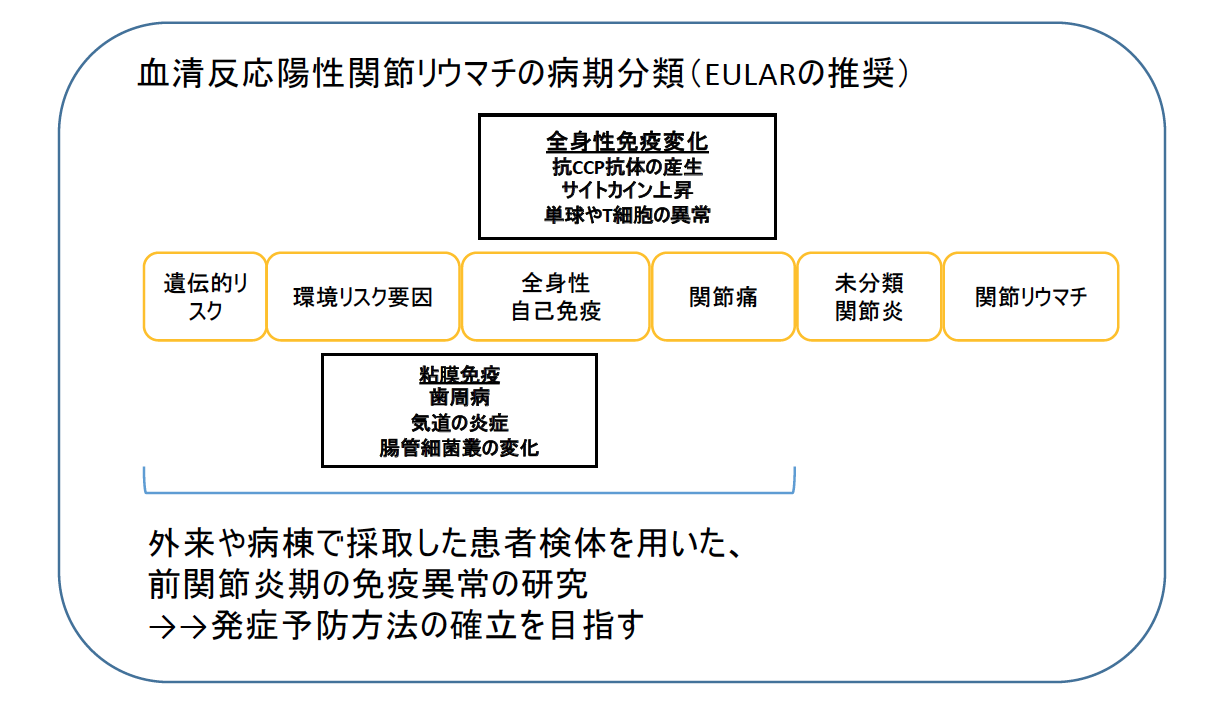
preclinical RAの研究(関節炎発症前の関節リウマチの病態研究)
当教室では、Preclinical RAの研究(関節炎発症前の関節リウマチの病態研究)を行っています。
近年、関節リウマチ(RA)患者さんの治療は飛躍的に改善しましたが、一旦発症した関節炎を「治癒」させることまではできないため、研究の焦点はハイリスク患者の発症予防に移行しつつあります。RAの発症を予防するには、発症予測因子の確立と、自己免疫的機序の解明が鍵となります。
当講座教員の岡本祐子らは、研究留学先のコロラド大学にて、気道粘膜面での慢性炎症、PAD (protein arginine deiminase)による蛋白のシトルリン化が、前関節炎期での抗CCP抗体の産生を誘導していることを報告しました。また、岡本らは、ヒト末梢血中T細胞を用いて、Th17細胞の分化を、PADが制御していることも報告しました。私たちは、現在、岡本を中心としてこれらの研究をさらに進めて、RA発症のリスク因子と、前関節炎期のT細胞の機能異常の関連を詳細に検討し、RA発症を予測する血中バイオマーカー、およびRAの予防的介入方法を開発することを目指して、精力的に研究しています。
1. 研究の概要
2. 膠原病リウマチ内科研究室での実験風景
- 外来や病棟で採取した患者さんの検体をすぐに処理・解析できる環境にあります
- フローサイトメーターや蛍光顕微鏡、Live cell imagingなどの専門的な実験機器は総合研究所のものを使用できます
- 測定を外部委託することで、マスサイトメトリー、シングルセルRNAシーケンスを用いた単一細胞レベルでの解析、メタゲノムショットガンシーケンスを用いた菌叢の解析など、新しい技術を用いたヒトバイオサンプルの解析を行える環境にあります

3. 蛍光染色、蛍光顕微鏡による免疫細胞の観察 (実験例1)
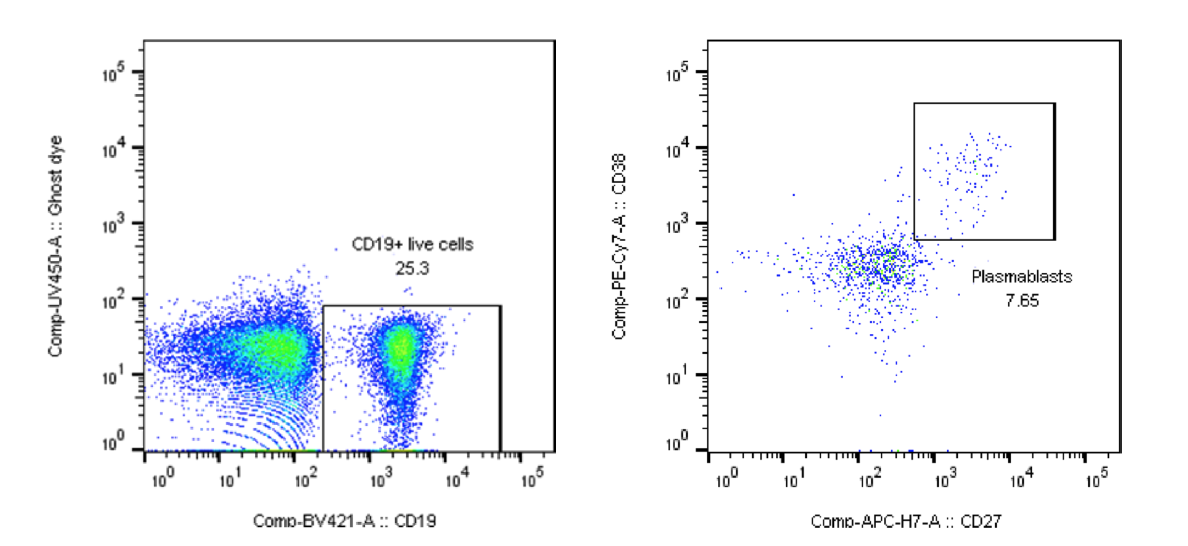
4. フローサイトメトリーによる末梢血免疫細胞の解析 (実験例2)
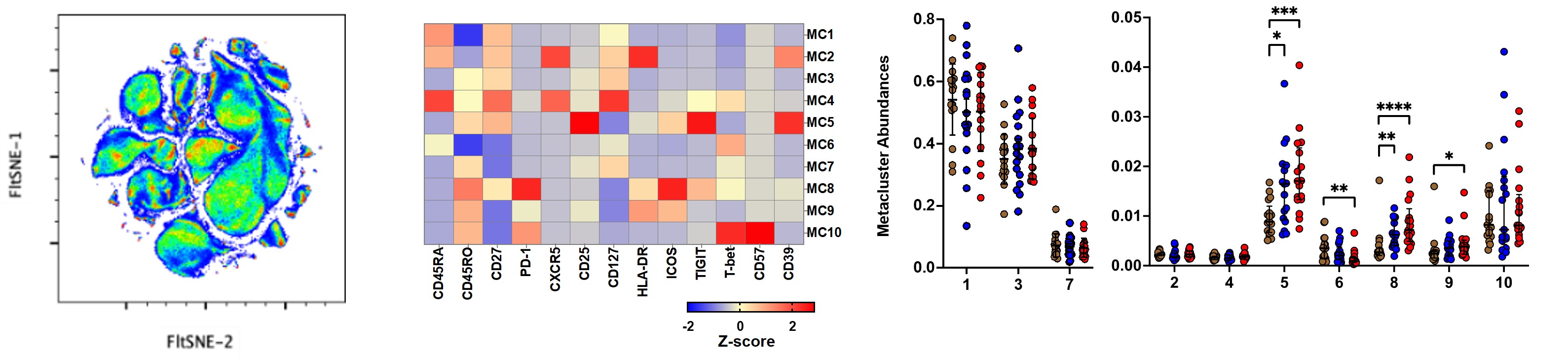
5. マスサイトメトリーと機械学習アルゴリズムによる末梢血免疫細胞の解析 (実験例3)
文責 岡本祐子
2026年1月6日 更新
全身性エリテマトーデス(SLE)に関する研究
当教室では、SLEに関連して、以下のような研究を行っています(スペースの都合上、ここで紹介している論文は2010年以降発行の、おもなもののみです)。
① 病態(基礎的)研究
おもに、患者さんからいただいたサンプル(血液や髄液)を用いて、SLEに関連したバイオマーカーの探索研究を行っています。例えば、抗C1q抗体(Arthritis Rheum. 2011;63:2436)、抗NR2受容体抗体(Arthritis Rheum. 2011;63:3952)、CNSループス関連自己抗体のプロテオミクス(Mol Cell Proteomics. 2011;10:M110.005330)、尿free light chain(Rheumatology. 2013;52:2149)、抗PLA2R抗体(Immunol Med. 2020;43:47)、可溶性PD-1(Lupus. 2020;29:686)などの意義を報告してきました。
さらに、 最近では、SLEの自然発症モデルBXSB-Yaaマウスの腎臓における、PD-1 (Programmed cell death protein-1)とそのリガンドの発現亢進と、末梢ヘルパーT細胞の増殖について報告しました(Lupus. 2024;33:816)。現在、この研究を発展させ、「遺伝子改変マウスを用いた、ループス腎炎の病態におけるPD-1とTph細胞の役割の解明」という課題名の研究を、科研費を獲得して実施しています。
また、SLEに関連した疾患感受性遺伝子 についても、研究・報告しています(Ann Rheum Dis. 2010;69:368、Arthritis Rheum. 2010;62:574、Mod Rheumatol. 2010;20:427、Mod Rheumatol. 2010;20:466、 PLoS Genet. 2012;8:e1002455など)。
② 臨床(疫学的)研究
当教室では、SLEに関してさまざまな臨床研究を行ってきました(例えば、BMC Musculoskelet Disord. 2010;11:13、BMC Womens Health. 2011;11:28、J Rheumatol. 2012;39:79、Psychosomatics. 2012;53:289、J Neurol. 2014;261:2150、J Rheumatol. 2015;42:441、Lupus. 2016;25:463、Lupus. 2019;28: 986、Mod Rheumatol. 2022;32:565など)。近年、私たちは、patient-reported outcomes (PRO)に注目しています。PROは、日本のリウマチ学研究者にはあまり注目されていませんでしたが、海外では、治験や観察研究のアウトカム指標として、PROが非常に重視されています。私たちは、SF-36という健康関連QoLを測定する包括的尺度の日本語版のSLE患者さんにおける妥当性を検証したり(Lupus. 2018;27:407、Mod Rheumatol. 2023;33:517)、Systemic Lupus Activity Questionnaire (SLAQ)、Lupus Damage Index Questionnaire (LDIQ)、LupusQoLといった、SLEに特化したPROの日本語版を作成し、その妥当性を検証しました(Lupus. 2016;25:486、Mod Rheumatol. 2021;31:834)。現在、それらを用いて、さまざまな前向き・後ろ向き観察研究を行っています。
2012年に設立された「The Asia Pacific Lupus Collaboration (APLC)」(https://www.asiapacificlupus.com/)、およびAPLCによって実施されている「The Lupus Low Disease Activity State (LLDAS) project」という、世界的にもたいへん注目されている、国際多施設共同研究に参加しています(Ann Rheum Dis. 2016;75:1615、Lancet Rheumatol 2019;1:e95、Lancet Rheumatol 2019;1:e103)。また、この国際多施設コホートのデータを用いて、さまざまな臨床・疫学研究を行われています(Lancet Rheumatol 2020;2:e24、Lancet Rheumatol. 2022;4:e822、Lancet Rheumatol. 2022;4:e831、Arthritis Rheumatol. 2023;75:401、Lancet Rheumatol. 2023;5:e584、Lancet Rheumatol. 2024;6:e528)。最近、当施設の勝又医師が筆頭・責任著者として発表した報告が、リウマチ学のトップジャーナルである
Annals of the Rheumatic Diseases誌に掲載されました(Ann Rheum Dis. 2024;83:998)。
文責 勝又康弘
2025年12月30日 更新
全身性硬化症(全身性強皮症)に関する研究
基礎医学研究
全身性硬化症(全身性強皮症)の基本的な病態として、微小血管障害、線維化が存在します。線維化が形成される過程では、病変局所の筋線維芽細胞の過剰なコラーゲン産生が重要な役割を担っています。筋線維芽細胞の形成やコラーゲン過剰産生には、TGF, PDGFのような成長因子やIL-1, IL-6, IL-13, IL-33などのサイトカインが関与しています。我々の研究により、IL-1α、IL-6, IL-33がコラーゲン産生に重要であることが解明されました (J Clin Invest. 1999; 103: 1253, Proc Natl Acad Sci USA. 2006; 103:14501)。その研究結果をもとに、抗IL-6受容体抗体の臨床研究が行われています。我々が行った臨床研究では、抗IL-6受容体抗体による皮膚硬化の改善効果が認められました (Mod Rheumatol. 2019; 29:134)。
近年では、線維芽細胞のコラーゲン産生に関わる細胞内分子を同定し、その分子の制御によって線維化を改善させる治療方法を開発する研究を進めています。現在、すでに3種類の分子を同定しており、その臨床応用を検討するために公的研究費の獲得を行っています (Arthritis Res Ther. 2019; 21:103)。
また、線維化に関わる酵素やキナーゼを阻害する新規の低分子化合物の有効性を培養系を用いて検討を進めています (Sci Rep. 2023; 13: 19378, Curr Opin Rhematol. 2023; 35: 309, Nat Commun. 2024; 15: 319)。
臨床医学研究
全身性硬化症の患者さんは、厚生労働省の調査では、日本に2.5万人前後登録がされています。当院では、そのうちの450名(2%程度)が通院中です。その多くの患者さんの治療経過をもとに臨床医学研究をおこなってきております。
間質性肺疾患に対して、シクロホスファミド静注療法を、日本においては先駆けて使用し、その有用性に関しての報告を行い (Mod Rheumatol. 2011; 21: 296)、2017年に発表された厚生労働省研究班の診療ガイドラインではその有用性が推奨されています。現在では、ニンテダニブというチロシンキナーゼ阻害薬によって間質性肺疾患に有効であることが証明されています。
肺動脈性肺高血圧症に対しては、早期から肺血管拡張薬を用いて治療を行っています。近年では、2025年から使用可能となったアクチビン刺激伝達阻害薬の有効性がSSc-PAHにも有効である可能性が示されていますが、この治療薬は我々の基礎研究の結果とよく合致しています(J Autoimmunity. 2011; 36: 181)
腸管の蠕動運動低下に関しては、抗ムスカリン受容体(M3)抗体の発現が関与していることを2009年に報告しました(Ann Rheum Dis. 2009; 68: 710)。この自己抗体の簡便な同定方法の確立とその除去による治療効果の検討が必要と考えております。
今後、抗線維化をターゲットとする分子標的治療薬の開発が進行中であり、新規治療薬の開発に貢献できるように臨床研究を立案して行っていく方針です。
文責 川口鎮司
2026年1月6日更新
多発筋炎・皮膚筋炎に関する研究
当教室では、多発筋炎・皮膚筋炎に関連して、以下のような研究を行っています(スペースの都合上、ここで紹介している論文は2010年以降発行の、おもなもののみです)。
① 病態(基礎的)研究
おもに、患者さんからいただいたサンプル(血清や筋肉)を用いて、多発筋炎・皮膚筋炎の病態研究を行っています。例えば、多発筋炎・皮膚筋炎患者筋組織において、hepatocyte growth factor (HGF)の発現が亢進していることを報告しています(Clin Immunol. 2010;136:387)。最近は、全身性エリテマトーデスおよび抗MDA5抗体陽性皮膚筋炎患者の血清によってI型インターフェロン経路を介して誘導される共通の単球サイトカインシグネチャーを報告しました(Immunol Lett. 2025:276:107066.)。また、多発筋炎・皮膚筋炎に関連した疾患感受性遺伝子についても、研究・報告しています(Mod Rheumatol. 2010;20:466、Ann Rheum Dis. 2012;71:1646、Arthritis Rheum. 2012;64:3736、PLoS One. 2014;9:e90019など)。
② 臨床(疫学的)研究
当教室では、多発筋炎・皮膚筋炎に関してさまざまな臨床研究を行ってきました。近年、私たちは、皮膚筋炎合併急速進行性間質性肺疾患に注目しています。そのベッドサイドで簡単に測定できるバイオマーカーとして、血清フェリチンの意義を初めて報告し、日本国内ではこの病態において広く測定されるようになっています(Rheumatology. 2010;49:1354、Rheumatology. 2010;49:1713、Rheumatology. 2010;49:1878、Rheumatology. 2012;51:1563、Biomed Res Int. 2014;2014:815245、Rheumatology. 2014;53:2196など)。フェリチン上昇の機序としては、マクロファージの異常活性化を想定し、その仮説検証のための研究を進めています(J Rheumatol. 2018;45:947など)。手法としては、flow cytometryやELISA、細胞培養などの免疫学的手法を用いています。また、2014年の学術論文(Curr Opin Rheumatol. 2014;26:724)において、共同研究可能なPM/DMレジストリー(症例登録システム)が世界には46あるとされ、当センターは日本国内で唯一その中に含まれています。現在、それを用いて、さまざまな前向き・後ろ向き観察研究を行っています(Biomed Res Int. 2016;2016:9163201, Mod Rheumatol. 2019;29:625など)。最近は、グルココルチコイド+シクロホスファミド+タクロリムスの3剤併用療法の抗MDA5抗体陽性皮膚筋炎合併間質性肺疾患に対する有用性を、後ろ向き研究で報告しました(Int J Rheum Dis. 2025;28:e70353)。
③ 「厚生労働科学研究費補助金 難治性疾患等政策研究事業・自己免疫疾患に関する調査研究班・多発性筋炎皮膚筋炎分科会」での活動
川口鎮司臨床教授が、上記研究班の班員となり、政策研究事業に参加しています。
④ The International Myositis Assessment and Clinical Studies Group (IMACS)での活動
多発筋炎・皮膚筋炎を含む炎症性ミオパチーの分類基準としては、1975年に発表されたBohanとPeterによる分類が、今日でも最も頻用されています。しかし、この基準にはいくつかの問題が指摘されており、当教室教員も所属する、IMACS(https://www.niehs.nih.gov/research/resources/imacs/index.cfm)という、国際的な筋炎研究グループが、新たな基準を作成しました(Ann Rheum Dis. 2017;76:1955)。このプロジェクトには、世界中の47施設が参加しましたが、当教室を含めた日本の4施設も含まれています。IMACSでは、その他にも、例えば、筋炎治療効果判定基準の策定(Ann Rheum Dis. 2017;76:792)、抗ARS抗体症候群の名称と略語についての合意形成(Rheumatology (Oxford). 2025;64:4930)などのようなプロジェクトにも、当施設の勝又医師が貢献しています。
文責 勝又康弘
2025年12月30日 更新
血管炎症候群に関する研究
当教室では、血管炎症候群に関連して、以下のような研究を行っています
① ANCA関連血管炎の疾患活動性バイオマーカーの探索
・プロテオミクスを用いたANCA関連血管炎の疾患活動性指標の新規血液バイオマーカーの同定(特許申請 特願2024-200941)
・ANCA測定法の特性比較
② ANCA関連血管炎・巨細胞性動脈炎の臨床疫学研究
・顕微鏡的多発血管炎(MPA)/多発血管炎性肉芽腫症(GPA)の再燃のリスク因子の検討
・実臨床下における、巨細胞性動脈炎(GCA)に対する寛解導入療法としてのグルココルチコイド(GC)とトシリズマブ(TCZ)の併用療法の有用性の検討
・ANCA関連血管炎患者における労働生産性及び活動障害と健康関連QoLの関連についての調査
文責 勝又康弘
2025年12月30日 更新

